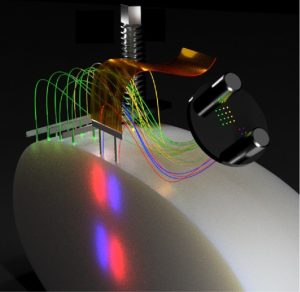
Schematische Darstellung einer möglichen Faser- und Elektrodenanordnung. Die dünnen Fasern ermöglichen sowohl räumliche Flexibilität als auch hochwertige extrazelluläre Aufzeichnungen. Mit freundlicher Genehmigung von Ilka Diester.

Prof. Dr. Ilka Diester
Auf dem Federation of European Neuroscience Societies Forum (FENS; 9.–13. Juli 2022) in Paris (Frankreich) unterhielten wir uns mit Diester über die verschiedenen Techniken, die sie in ihrer Forschung verwendet, einschließlich Ein-Photonen-Bildgebung, und sprachen darüber, was virtuelle Realität ist (VR) wirkt sich auf unser Gehirn aus.
Was haben Sie auf der FENS 2022 präsentiert?
In einem Vortrag habe ich optimierte Sonden für die In-vivo-Optogenetik und Elektrophysiologie und die Einstellungen zu neuen Techniken mit mehreren Fasern vorgestellt, mit denen man verschiedene Gehirnseiten steuern kann. Diese Fasern können separat von einer laminaren elektrophysiologischen Sonde implantiert werden. Diese Fasern sind superdünn und zerstören weniger Gewebe. Daher ermöglichen sie ein ultraschnelles optogenetisches Silencing, da sie sehr nahe an intakten Zellkörpern implantiert werden können [1].
In dem Vortrag habe ich auch eine optoelektrofluidische Sonde vorgestellt, eine multifunktionale Sonde, die das Injektionssystem mit dem Aufnahmesystem und dem Stimulationssystem kombiniert, was dann zu sehr genauen Expressionsprofilen des Opsins führt und Operationen vereinfacht [2].
Zuletzt habe ich auch eine Technik vorgestellt, um Studenten mit 3D-gedruckten Schädeln und einem künstlichen Gehirn zu trainieren [3] – ich habe tatsächlich die meisten Fragen zu diesem Aspekt des Vortrags erhalten, und die Studenten waren wirklich begeistert von dieser Technik.
Wir hatten auch ein Poster über eine kürzlich in Neuron veröffentlichte Technik namens FreiPose, ein Werkzeug zur 3D-Markierungs-freien Verfolgung von Tieren [4]. Wir hatten ein weiteres Poster über eine Open-Source-Toolbox für Ein-Photonen-Bildgebung und Aufgaben zur Verhaltensflexibilität.
Welche Techniken verwenden Sie, um das Gehirn und die Bahnen zu untersuchen, die das motorische Verhalten beeinflussen?
Die Optogenetik ist eines unserer wichtigsten Werkzeuge. Wir verwenden dies, um entweder die lokale Aktivität zu kontrollieren, indem wir sie hemmen oder anregen, oder zunehmend, um die pfadspezifische Aktivität mit einem Cre-Lox-System zu kontrollieren. In diesem System wandert ein Cre-Virus rückwärts und es wird ein DIO-Konstrukt verwendet, das unter der Kontrolle des Opsins steht.
Wir verwenden auch die Elektrophysiologie, bei der horizontale Arrays aus mehreren Elektroden über den Kortex oder die tieferen Hirnstrukturen oder Neuropixel-Sonden oder Lamina-Sonden implantiert werden.
Wir haben einige Studien an Mäusen zur Ein-Photonen-Bildgebung mit Miniskopen sowie zur Zwei-Photonen-Bildgebung in Schichten oder in vivo. Für den In-vivo-Teil sind wir besonders gespannt auf das Holographiesystem, das es uns ermöglicht, holographische Muster (im Grunde physiologisch sinnvolle Muster zu schreiben) in das Gehirn zu schreiben.
Auf welche Herausforderungen sind Sie in Ihrer Forschung gestoßen?
Wir arbeiten oft mit Standardwerkzeugen und stellen dann fest, dass etwas nicht optimal ist. Wenn Sie beispielsweise die ungenauen Expressionseigenschaften betrachten und nur die Standard-Injektionssysteme verwenden, kommt es manchmal zu einem Rückfluss des viralen Vektors, wenn Sie die Nadel zurückziehen.
Eine weitere Herausforderung besteht darin, dass jedes Mal, wenn Sie etwas in das Gehirn einführen, es Schaden anrichtet, insbesondere wenn Sie zu tieferen Strukturen im Gehirn vordringen oder die Dura (die dicke äußere Membran des Gehirns) entfernen oder sich um Blutgefäße herum zurechtfinden müssen. Dünne Fasern sind dabei hilfreich.
Schließlich sind optoelektronische Artefakte eine Herausforderung, da sie Signale verfälschen können. Manchmal helfen neue Materialien, zum Beispiel scheint Graphen derzeit eine der Lösungen zu sein.
Wie entwickelt man optoelektronische Sonden, um die Herausforderungen in diesem Forschungsfeld zu meistern?
Da ich Neurowissenschaftlerin und kein Neuro Ingenieurin bin, spreche ich mit meinen Kollegen aus der technischen Abteilung, wenn ich Sonden entwickle, die praktischerweise im selben Gebäude wie wir sitzen. Im Gebäude Intelligent Machine Brain Interfacing Technology (IMBIT) haben wir Neurobiologen, Neuro Ingenieure, Informatiker und KI-Spezialisten. Ich habe auch einige wirklich talentierte Studenten im Labor, die motiviert sind, diese Tools weiterzuentwickeln. Wir arbeiten mit Ingenieuren zusammen, um eine gute Lösung für diese Probleme zu finden. Die meisten Artikel, die ich kürzlich veröffentlicht habe, sind in Zusammenarbeit mit Ingenieuren entstanden, weil es sehr fruchtbar ist.
Da Sie auch Sprecherin von BrainLinks-BrainTools (Universität Freiburg, Deutschland) sind, könnten Sie einen allgemeinen Überblick über deren Forschungsprojekte geben?
In BrainLinks-Brain Tools, das eng mit IMBIT verknüpft ist, gibt es drei verschiedene Themen. Ich bin der Sprecher von NeuroCore, bei dem es um grundlegende Neurowissenschaften geht. Es gibt auch NeuroProbes, bei dem es um die Sonden-Entwicklung geht, einschließlich elektrophysiologischer Sonden, optogenetischer Sonden, Elektrokortikographie-Arrays und so weiter. Schließlich haben wir einen Bereich namens NeuroRobotics, der im Bereich der KI liegt und Kliniken und Gehirn-Maschine-Schnittstellentechnologie eng miteinander verbindet. In jedem dieser Forschungsbereiche haben wir mehrere Projekte und einige große Geräte, die wir verwenden.
In meinem Bereich, dem NeuroCore, haben wir eine Forschungseinheit, die wir OptoRoboRat nennen. Das ist wie eine Kombination aus einem Zwei-Photonen-Mikroskop mit einer holografischen Einheit, mit der wir Muster einschreiben können. Dies wird mit VR kombiniert, sodass Mäuse auf einem Rad laufen und denken, dass sie sich bewegen. Parallel dazu haben wir ein Setup mit einer sich frei bewegenden Maus, die dasselbe erlebt. Wir haben die Möglichkeit, die Maus zwischen den beiden Setups zu wechseln, damit wir die neuronale Aktivität in VR und in der realen Realität vergleichen können. Das ist für mich eine faszinierende Frage: Was macht VR mit unserem Gehirn oder mit dem Mausgehirn? Einige Beweise haben gezeigt, dass VR im Vergleich zur realen Realität eine verringerte Neuronenaktivität verursacht. Ich denke, das ist gerade jetzt eine sehr relevante Frage für die Gesellschaft, weil wir immer mehr in VR eintauchen, aber was macht es mit uns? Dies ist zu wenig erforscht. Diese ist mit der Robotergruppe in BrainLinks-BrainTools verknüpft. Wir haben einen kleinen vierbeinigen Roboter, der wie eine Ratte oder ein Hund aussieht, und die Idee ist, dass dieser Roboter Informationen über die Umgebung sammelt und sie an die Maus auf dem Zielfernrohr zurückgibt, während die neuronale Aktivität der Maus dies steuert Roboter. Es ist ein geschlossenes System.
Wir haben auch das Soft-FIB, das zur Analyse der Gewebe-Sonden-Interaktion dient. Mit diesem Gerät können wir Gehirnimplantate mit einer Elektrode durchschneiden, ohne die Elektrode zu entfernen, und dann können wir uns die Schnittmenge ansehen. Dies ist wichtig, weil wir wissen, dass es Glianarben und eine gewisse Immunantwort im Gehirn gibt, obwohl es keine wirkliche Immunantwort hat, da Astrozyten vorhanden sind.
Schließlich gibt es noch den Fokus auf die Maschine-Gehirn-Schnittstelle, wo wir eine sehr fortschrittliche Aufnahmetechnik beim Menschen haben, die mit einem Roboterarm verbunden ist. Kliniker und KI-Forscher entwickeln an dieser Schnittstelle einige neue Ideen und Werkzeuge.
Wie sieht die zukünftige Forschungsrichtung Ihres Labors aus?
Im Moment hat mein Labor zwei Streams: einen kognitiven Stream und einen motorischen Kontrollstream. Mein Ziel ist es, diese beiden Seiten zusammenzubringen, weil sie natürlich miteinander verbunden sind. Wann immer wir eine kognitive Entscheidung oder Verhaltensflexibilität haben, die dann zu einer kognitiven Entscheidung führt, muss dies in eine motorische Leistung übersetzt werden. Aber wie werden die Informationen übertragen? Das klingt super einfach, aber die Antwort ist nicht klar, und das ist die zukünftige Ausrichtung meines Labors.
Was wird Ihrer Meinung nach die größte Entwicklung in Ihrem Forschungsgebiet in den nächsten Jahren sein?
Im Moment freue ich mich am meisten darauf, die Zwei-Photonen-Bildgebung bei sich frei bewegenden Tieren durchzuführen, die kürzlich durchgeführt und veröffentlicht wurde. Ich denke, der nächste Schritt, vielleicht sogar früher als Jahre, besteht darin, auch holografische Stimulation bei sich frei bewegenden Tieren durchzuführen. Neuroingenieure haben einige intelligente Lösungen dafür entwickelt. Das wäre super mächtig, denn dann können Sie alles, was Sie im Moment tun, mit einer festen Maus tun, aber mit einer frei beweglichen Maus. Jeder, der Verhaltensanalysen oder -training betreibt, weiß, dass es einfacher ist, eine Maus in einem frei beweglichen Zustand zu trainieren. Sie performen einfach besser. Darüber hinaus sind unter frei beweglichen Bedingungen naturgetreuere Aufgaben möglich.
Quelle:
Pressemitteilung von BioTechniques